Materi IPAS zat dan perubahannya kelas 10 akan mengajak kita menjelajahi dunia menarik tentang materi di sekitar kita. Dari pengertian zat dan perubahannya hingga klasifikasi, struktur, dan faktor-faktor yang mempengaruhinya, kita akan menyelami bagaimana zat-zat di sekeliling kita berubah dan berinteraksi.
Materi ini akan membahas definisi materi dan zat, jenis-jenis perubahan materi (fisika dan kimia), klasifikasi zat berdasarkan wujud dan sifatnya, struktur materi, serta faktor-faktor yang mempengaruhi laju perubahan materi. Contoh-contoh konkret dan ilustrasi akan mempermudah pemahaman kita tentang konsep-konsep tersebut.
Definisi Materi IPS dan Perubahannya
Materi dan perubahannya merupakan konsep dasar dalam ilmu pengetahuan alam. Memahami materi dan perubahannya sangat penting untuk memahami fenomena alam di sekitar kita. Artikel ini akan menjelaskan pengertian materi, zat, dan perubahannya dalam konteks kelas 10, memberikan contoh, serta mengidentifikasi jenis-jenis perubahan materi yang terjadi.
Pengertian Materi, Zat, dan Perubahannya
Materi adalah segala sesuatu yang menempati ruang dan memiliki massa. Zat merupakan bentuk spesifik dari materi yang memiliki komposisi dan sifat tertentu. Perubahan materi adalah proses di mana suatu zat berubah menjadi zat lain atau mengalami perubahan sifat.
Contoh Materi dan Zat di Sekitar Kita
- Udara yang kita hirup adalah materi dalam bentuk gas.
- Air yang kita minum adalah zat dalam bentuk cair.
- Meja dan kursi di kelas adalah materi dalam bentuk padat.
- Logam besi, kayu, dan plastik merupakan contoh zat padat yang berbeda.
- Berbagai jenis makanan dan minuman merupakan contoh zat yang berbeda.
Jenis-Jenis Perubahan Materi
Perubahan materi dapat dibedakan menjadi perubahan fisika dan perubahan kimia. Perubahan fisika tidak mengubah komposisi zat, sementara perubahan kimia mengubah komposisi zat menjadi zat baru.
Perbedaan Perubahan Fisika dan Kimia
| Karakteristik | Perubahan Fisika | Perubahan Kimia |
|---|---|---|
| Komposisi zat | Tidak berubah | Berubah menjadi zat baru |
| Sifat zat | Mungkin berubah (bentuk, wujud, dll.) | Sifat zat berubah secara permanen |
| Energi | Seringkali menyerap atau melepaskan energi dalam jumlah kecil | Seringkali menyerap atau melepaskan energi dalam jumlah besar |
| Kembalikan | Seringkali dapat dikembalikan ke bentuk semula | Biasanya tidak dapat dikembalikan ke bentuk semula |
Ilustrasi Perubahan Zat
Contoh perubahan zat meliputi mencair (padat ke cair), membeku (cair ke padat), menguap (cair ke gas), dan mengembun (gas ke cair). Proses ini melibatkan perubahan wujud zat tanpa mengubah komposisinya. Misalnya, es batu yang mencair menjadi air. Air yang menguap menjadi uap air. Proses-proses ini terjadi di sekitar kita, dan dapat diamati dengan mudah.
Klasifikasi Zat
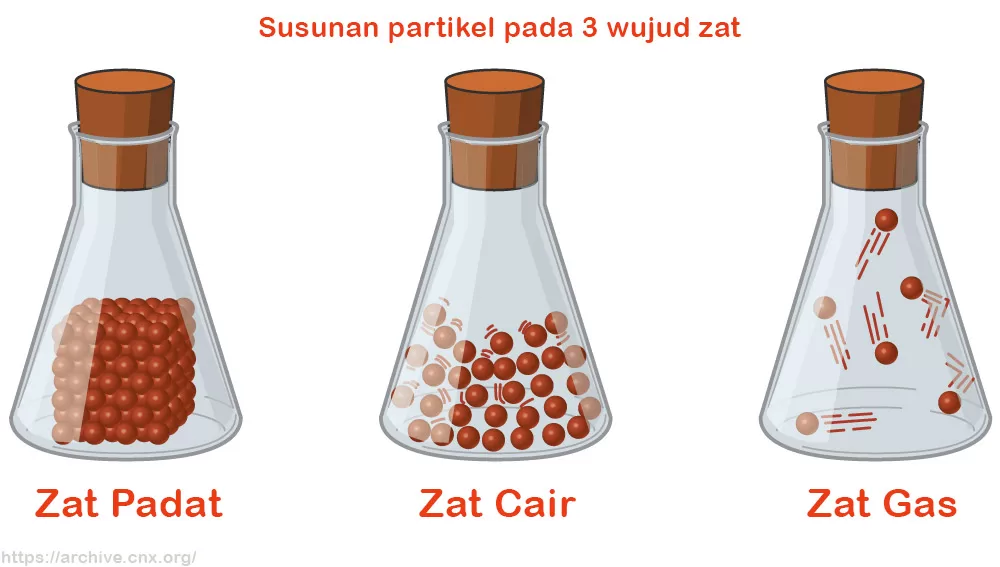
Memahami berbagai macam zat di sekitar kita menjadi penting. Klasifikasi zat membantu kita mengorganisir dan mempelajari sifat-sifatnya dengan lebih mudah. Pengelompokan ini didasarkan pada wujud dan sifat zat itu sendiri.
Klasifikasi Berdasarkan Wujud
Zat dapat diklasifikasikan berdasarkan wujudnya, yaitu padat, cair, dan gas. Perbedaan wujud ini berkaitan erat dengan susunan dan gaya tarik antar partikel penyusun zat.
| Wujud | Deskripsi | Contoh |
|---|---|---|
| Padat | Partikel-partikel zat sangat berdekatan dan tersusun rapi, sehingga memiliki bentuk dan volume tetap. | Kayu, batu, besi |
| Cair | Partikel-partikel zat lebih renggang dibandingkan zat padat, sehingga memiliki volume tetap namun bentuknya berubah sesuai wadahnya. | Air, minyak, bensin |
| Gas | Partikel-partikel zat sangat renggang dan bergerak bebas, sehingga bentuk dan volumenya berubah sesuai wadahnya. | Udara, oksigen, nitrogen |
Sifat-Sifat Zat, Materi ipas zat dan perubahannya kelas 10
Setiap zat memiliki sifat-sifat yang membedakannya dari zat lain. Sifat-sifat ini dapat diamati secara langsung atau diukur dengan alat.
- Warna: Merupakan sifat yang mudah diamati, seperti warna merah pada darah atau biru pada air laut.
- Bau: Sifat ini dapat tercium oleh indra penciuman, misalnya bau harum bunga mawar atau bau menyengat gas LPG.
- Titik leleh: Suhu saat zat padat berubah menjadi cair. Titik leleh es adalah 0 derajat Celcius.
- Titik didih: Suhu saat zat cair berubah menjadi gas. Titik didih air adalah 100 derajat Celcius pada tekanan atmosfer standar.
Perbedaan sifat-sifat ini memungkinkan kita untuk mengidentifikasi jenis zat yang berbeda.
Perbedaan Sifat Fisika dan Kimia
Sifat fisika dapat diamati tanpa mengubah komposisi zat, sedangkan sifat kimia berkaitan dengan perubahan komposisi zat.
- Sifat Fisika: Warna, titik leleh, titik didih, massa jenis, kelarutan, kekerasan, dan konduktivitas listrik merupakan contoh sifat fisika.
- Sifat Kimia: Reaktivitas terhadap asam, kemampuan berkarat, kemampuan terbakar, dan perubahan warna saat bereaksi dengan zat lain merupakan contoh sifat kimia.
Memahami perbedaan ini penting dalam menganalisis dan mengklasifikasikan zat.
Perubahan Wujud Zat dan Partikel
Perubahan wujud zat terjadi karena perubahan energi kinetik partikel penyusun zat. Ketika energi kinetik meningkat, partikel bergerak lebih cepat dan gaya tarik antar partikel melemah, sehingga wujud zat berubah.
- Mencair: Padat berubah menjadi cair, misalnya es mencair menjadi air. Energi kinetik partikel meningkat.
- Membeku: Cair berubah menjadi padat, misalnya air membeku menjadi es. Energi kinetik partikel menurun.
- Menguap: Cair berubah menjadi gas, misalnya air menguap menjadi uap air. Energi kinetik partikel meningkat.
- Mengembun: Gas berubah menjadi cair, misalnya uap air mengembun menjadi air. Energi kinetik partikel menurun.
- Menyublim: Padat berubah langsung menjadi gas, misalnya es kering menyublim menjadi gas karbon dioksida. Energi kinetik partikel meningkat secara signifikan.
- Mengkristal: Gas berubah langsung menjadi padat, misalnya uap air berubah menjadi salju atau embun beku. Energi kinetik partikel menurun secara signifikan.
Struktur Materi
Struktur materi adalah bagaimana partikel-partikel penyusun materi tersusun dan berikatan satu sama lain. Pemahaman tentang struktur ini sangat penting untuk memahami sifat-sifat materi yang beragam. Dari atom hingga molekul, ikatan kimia memainkan peran krusial dalam menentukan karakteristik suatu zat.
Teori Atom dan Pembentukan Molekul
Teori atom menjelaskan bahwa materi tersusun dari partikel-partikel terkecil yang disebut atom. Atom terdiri dari inti atom yang mengandung proton dan neutron, serta elektron yang mengelilingi inti. Model atom yang paling umum digunakan adalah model atom Bohr. Model ini menggambarkan elektron yang bergerak mengelilingi inti pada lintasan-lintasan tertentu.
Atom-atom dapat berikatan satu sama lain untuk membentuk molekul. Ikatan-ikatan ini terbentuk karena interaksi antara elektron-elektron di atom-atom tersebut. Interaksi ini menyebabkan atom-atom terikat dan membentuk struktur yang lebih kompleks.
Diagram di atas menunjukkan model atom sederhana. Inti atom terdiri dari proton (bermuatan positif) dan neutron (tidak bermuatan). Elektron (bermuatan negatif) mengelilingi inti pada orbit tertentu.
Ikatan Kimia
Ikatan kimia adalah gaya tarik-menarik yang memegang atom-atom bersama dalam suatu molekul atau kristal. Jenis ikatan kimia yang utama adalah ikatan ionik, kovalen, dan logam.
- Ikatan Ionik: Ikatan ini terjadi karena transfer elektron dari satu atom ke atom lain. Atom yang kehilangan elektron menjadi ion positif (kation), sedangkan atom yang menerima elektron menjadi ion negatif (anion). Gaya tarik-menarik elektrostatis antara ion-ion berlawanan muatan ini membentuk ikatan ionik. Contohnya adalah NaCl (garam dapur), yang terbentuk dari ikatan ionik antara ion natrium (Na +) dan ion klorida (Cl –).
- Ikatan Kovalen: Ikatan ini terjadi karena pemakaian bersama pasangan elektron oleh dua atom. Elektron-elektron ini bergerak di sekitar inti kedua atom. Ikatan kovalen dapat berupa tunggal, rangkap dua, atau rangkap tiga tergantung pada jumlah pasangan elektron yang dipakai bersama. Contohnya adalah H 2O (air), yang terbentuk dari ikatan kovalen antara atom hidrogen dan oksigen.
- Ikatan Logam: Ikatan ini terjadi karena elektron-elektron valensi dari atom-atom logam bergerak bebas di dalam suatu “lautan elektron”. Elektron-elektron ini tidak terikat pada atom tertentu, melainkan bergerak bebas di seluruh struktur logam. Gaya tarik-menarik antara ion-ion positif dan elektron-elektron bebas ini membentuk ikatan logam. Contohnya adalah besi (Fe), tembaga (Cu), dan aluminium (Al).
Perbandingan Ikatan Kimia
| Jenis Ikatan | Cara Terbentuk | Contoh | Sifat Umum |
|---|---|---|---|
| Ionik | Transfer elektron | NaCl (garam dapur) | Padatan kristal, titik leleh tinggi, larut dalam air |
| Kovalen | Pemakaian bersama pasangan elektron | H2O (air) | Berbagai fase (padat, cair, gas), titik leleh rendah, tidak larut dalam air |
| Logam | Elektron bebas | Fe (besi) | Konduktor panas dan listrik, titik leleh tinggi |
Pengaruh Struktur Materi terhadap Sifat Materi
Struktur materi, termasuk jenis ikatan kimia dan susunan atom/molekul, secara langsung memengaruhi sifat-sifat materi. Misalnya, materi dengan ikatan ionik cenderung memiliki titik leleh dan titik didih yang tinggi karena gaya tarik-menarik antar ion yang kuat. Sebaliknya, materi dengan ikatan kovalen dapat berupa gas, cair, atau padat pada suhu kamar, tergantung pada kekuatan ikatan dan ukuran molekulnya. Struktur kristal juga dapat memengaruhi kekerasan dan ketahanan suatu material.
Perubahan Fisika: Materi Ipas Zat Dan Perubahannya Kelas 10

Perubahan fisika merupakan peristiwa di mana zat mengalami perubahan bentuk atau wujud tanpa mengubah komposisi kimianya. Proses ini seringkali melibatkan perubahan energi, namun tidak menghasilkan zat baru.
Contoh Perubahan Fisika di Sekitar Kita
Banyak sekali contoh perubahan fisika yang kita temui dalam kehidupan sehari-hari. Berikut beberapa contohnya:
- Mencairnya es batu: Es batu, yang awalnya padat, berubah menjadi air cair ketika dipanaskan. Komposisi molekul air tetap sama, hanya wujudnya yang berubah.
- Mendidihnya air: Air yang mendidih berubah wujud dari cair menjadi uap. Molekul air tetap sama, hanya wujudnya yang berubah.
- Menyaring kopi: Proses penyaringan kopi tidak mengubah komposisi kimia kopi. Hanya partikel kopi yang terpisah dari air.
- Membengkokkan kawat: Membengkokkan kawat mengubah bentuknya, tetapi tidak mengubah komposisi kimianya.
- Mematahkan kayu: Mematahkan kayu mengubah bentuknya, tetapi tidak mengubah komposisi kimianya.
Proses Perubahan Fisika dan Sifat Zat
Dalam perubahan fisika, struktur molekul zat tidak berubah. Hanya susunan dan gaya tarik antar molekul yang berubah. Hal ini menyebabkan perubahan wujud atau bentuk zat, namun sifat kimianya tetap sama. Misalnya, air tetaplah H 2O baik dalam wujud padat (es), cair, atau gas (uap).
Rangkum Perubahan Fisika
Berikut poin-poin penting terkait perubahan fisika:
- Perubahan fisika tidak mengubah komposisi kimia zat.
- Sifat kimia zat tetap sama sebelum dan sesudah perubahan fisika.
- Perubahan fisika sering melibatkan perubahan energi, seperti panas atau listrik.
- Contoh perubahan fisika meliputi mencair, membeku, menguap, mengembun, dan perubahan bentuk.
Diagram Alur Perubahan Fisika
Diagram alur berikut menggambarkan tahapan umum dalam perubahan fisika:
| Tahap | Deskripsi |
|---|---|
| 1. Zat Awal | Zat berada dalam wujud awal (padat, cair, atau gas). |
| 2. Energi Masuk | Energi (panas, listrik, dll) diberikan pada zat. |
| 3. Perubahan Wujud/Bentuk | Zat mengalami perubahan wujud atau bentuk. |
| 4. Zat Akhir | Zat berada dalam wujud atau bentuk baru. |
Peran Energi dalam Perubahan Fisika
Energi berperan penting dalam perubahan fisika. Energi dapat berupa panas, listrik, atau bentuk energi lainnya. Energi yang diberikan pada zat akan menyebabkan perubahan dalam susunan dan gaya tarik antar molekul, sehingga mengakibatkan perubahan wujud atau bentuk.
Contohnya, untuk meleburkan es batu (perubahan dari padat ke cair), diperlukan energi panas. Energi panas tersebut meningkatkan energi kinetik molekul air, sehingga gaya tarik antar molekul melemah dan es batu berubah menjadi air cair.
Perubahan Kimia
Perubahan kimia merupakan proses transformasi zat yang menghasilkan zat baru dengan sifat-sifat yang berbeda dari zat awal. Proses ini melibatkan perubahan struktur molekul dan atom, yang seringkali disertai dengan perubahan energi, seperti pelepasan atau penyerapan panas.
Contoh Perubahan Kimia di Sekitar Kita
Banyak sekali contoh perubahan kimia yang terjadi di sekitar kita, mulai dari reaksi sederhana hingga yang lebih kompleks. Berikut beberapa contohnya:
- Pembakaran kayu: Kayu yang terbakar bereaksi dengan oksigen di udara membentuk gas karbon dioksida, air, dan menghasilkan energi panas dan cahaya. Zat awal (kayu) berubah menjadi zat-zat baru (gas karbon dioksida, air, abu).
- Pencernaan makanan: Proses pencernaan melibatkan reaksi kimia yang memecah molekul-molekul kompleks dalam makanan menjadi molekul-molekul yang lebih sederhana untuk diserap tubuh. Misalnya, karbohidrat dipecah menjadi glukosa.
- Perkaratan besi: Besi yang terpapar udara dan air bereaksi membentuk karat (besi(III) oksida hidrat). Proses ini mengubah sifat besi menjadi lebih rapuh dan mudah hancur.
- Pembuatan roti: Proses pembuatan roti melibatkan reaksi kimia antara bahan-bahan seperti tepung, ragi, dan air. Reaksi kimia tersebut menghasilkan gas karbon dioksida yang membuat roti mengembang.
Proses Perubahan Kimia dan Pembentukan Zat Baru
Perubahan kimia melibatkan reorganisasi atom-atom dan molekul-molekul dari zat awal. Dalam proses ini, ikatan kimia pada zat awal putus dan terbentuk ikatan kimia baru yang berbeda, sehingga menghasilkan zat baru dengan sifat-sifat yang berbeda. Perubahan ini dapat diiringi oleh perubahan energi, baik pelepasan atau penyerapan panas. Sebagai contoh, pembakaran kayu melepaskan energi panas dan cahaya.
Ciri-Ciri Perubahan Kimia
Perubahan kimia dapat diidentifikasi melalui beberapa ciri-ciri yang dapat diamati, diantaranya:
- Terbentuknya zat baru: Zat awal mengalami perubahan struktur molekul dan membentuk zat baru dengan sifat-sifat yang berbeda.
- Perubahan warna: Perubahan warna dapat terjadi pada proses perubahan kimia, misalnya pada pembakaran kayu yang menghasilkan abu berwarna abu-abu atau coklat.
- Perubahan suhu: Reaksi kimia dapat menyerap atau melepaskan energi panas. Jika melepaskan energi panas, reaksi tersebut disebut eksotermik, sementara jika menyerap energi panas, reaksi tersebut disebut endotermik. Contohnya, reaksi pembakaran kayu merupakan reaksi eksotermik karena melepaskan panas.
- Terbentuknya gas: Beberapa reaksi kimia menghasilkan gas, misalnya pada pembuatan roti. Gas yang terbentuk dapat dilihat sebagai gelembung atau perubahan volume.
- Terbentuknya endapan: Reaksi kimia tertentu dapat menghasilkan endapan yang tidak larut. Endapan ini dapat diamati sebagai padatan yang mengendap di dasar larutan.
Tabel Reaksi Kimia dan Produk yang Dihasilkan
| Reaksi Kimia | Produk yang Dihasilkan |
|---|---|
| Pembakaran metana (CH4) dengan oksigen (O2) | Karbon dioksida (CO2) dan air (H2O) |
| Reaksi antara natrium (Na) dengan air (H2O) | Natrium hidroksida (NaOH) dan gas hidrogen (H2) |
| Perkaratan besi (Fe) | Besi(III) oksida hidrat (Fe2O3.xH2O) |
Energi dalam Perubahan Kimia
Energi berperan penting dalam perubahan kimia. Reaksi kimia dapat menyerap atau melepaskan energi dalam bentuk panas, cahaya, atau energi lainnya. Reaksi eksotermik melepaskan energi, sementara reaksi endotermik menyerap energi. Energi ini berkaitan erat dengan ikatan kimia yang terbentuk dan putus selama reaksi.
Faktor-faktor yang Mempengaruhi Perubahan Materi

Perubahan materi, baik secara fisika maupun kimia, dipengaruhi oleh berbagai faktor. Memahami faktor-faktor ini penting untuk memprediksi dan mengontrol laju perubahan tersebut.
Faktor-faktor yang Mempengaruhi Laju Perubahan Materi
Beberapa faktor yang berpengaruh terhadap kecepatan perubahan materi meliputi suhu, tekanan, luas permukaan, konsentrasi, dan penggunaan katalis. Masing-masing faktor memberikan dampak yang berbeda terhadap laju reaksi.
- Suhu: Peningkatan suhu umumnya mempercepat laju reaksi. Hal ini karena energi kinetik partikel meningkat, sehingga peluang tumbukan yang efektif antara partikel-partikel reaktan juga meningkat. Contohnya, reaksi pembakaran kayu akan lebih cepat pada suhu tinggi.
- Tekanan: Tekanan yang lebih tinggi dapat mempercepat laju reaksi, terutama untuk reaksi yang melibatkan gas. Peningkatan tekanan menyebabkan partikel-partikel gas lebih dekat satu sama lain, sehingga peluang tumbukan antar partikel juga meningkat. Contohnya, pada proses sintesis amonia (Haber-Bosch), tekanan tinggi digunakan untuk meningkatkan laju reaksi.
- Luas Permukaan: Semakin besar luas permukaan reaktan, semakin cepat laju reaksinya. Hal ini karena semakin banyak area kontak antara reaktan yang tersedia untuk bereaksi. Contohnya, serbuk logam bereaksi lebih cepat daripada logam dalam bentuk bongkahan karena luas permukaannya yang lebih besar.
Pengaruh Konsentrasi pada Laju Reaksi
Konsentrasi reaktan juga berpengaruh terhadap laju reaksi. Semakin tinggi konsentrasi reaktan, semakin sering partikel-partikel reaktan saling bertabrakan, sehingga meningkatkan laju reaksi. Contohnya, larutan asam pekat akan bereaksi lebih cepat dibandingkan dengan larutan asam encer dengan konsentrasi yang sama.
Pengaruh Katalis pada Laju Reaksi
Katalis adalah zat yang dapat mempercepat laju reaksi tanpa terkonsumsi dalam reaksi tersebut. Katalis bekerja dengan menurunkan energi aktivasi yang dibutuhkan untuk memulai reaksi. Katalis dapat mempercepat reaksi kimia dengan menyediakan jalur reaksi alternatif yang memiliki energi aktivasi lebih rendah. Katalis tidak mengubah produk akhir reaksi, hanya mempercepat prosesnya.
- Peran Katalis: Katalis berperan penting dalam berbagai proses industri dan biologis. Contohnya, enzim dalam tubuh kita berperan sebagai katalis untuk mempercepat berbagai reaksi biokimia.
- Katalis Positif dan Negatif: Katalis dapat mempercepat (katalis positif) atau memperlambat (katalis negatif atau inhibitor) laju reaksi. Katalis negatif dapat mencegah reaksi berlangsung dengan mengikat reaktan dan membentuk kompleks yang tidak reaktif.
Diagram Pengaruh Faktor-faktor terhadap Laju Perubahan
Diagram yang menggambarkan pengaruh berbagai faktor terhadap laju reaksi bisa berupa grafik atau diagram alir. Grafik biasanya menggambarkan hubungan antara faktor-faktor tersebut dengan laju reaksi. Diagram alir dapat menunjukkan langkah-langkah yang terjadi dalam reaksi yang dikatalisis.
Catatan: Diagram tidak dapat ditampilkan di sini.
Ringkasan Faktor-faktor yang Mempengaruhi Laju Reaksi
Secara ringkas, faktor-faktor yang mempengaruhi laju reaksi meliputi suhu, tekanan, luas permukaan, konsentrasi, dan penggunaan katalis. Masing-masing faktor memberikan dampak yang berbeda terhadap kecepatan reaksi. Pemahaman tentang faktor-faktor ini sangat penting dalam mengontrol dan memprediksi laju perubahan materi.
Penutupan Akhir
Dalam perjalanan memahami materi zat dan perubahannya, kita telah mempelajari berbagai aspek penting. Dari definisi hingga faktor-faktor yang mempengaruhinya, kita telah melihat betapa kompleks dan menariknya dunia materi di sekitar kita. Semoga pemahaman ini memberikan fondasi yang kuat untuk eksplorasi lebih lanjut tentang ilmu pengetahuan alam.